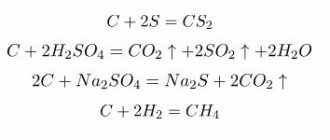Здравствуйте, дорогие наши читатели! Вы когда-нибудь задумывались, алмаз и графит — что может быть у них общего? Казалось бы, алмаз – это то, из чего делают дорогие украшения, радующие глаз человека даже с самым утонченным вкусом. Твердый, жесткий и практически неразрушимый. И графит – основной элемент для изготовления карандашей, очень хрупкий и легко ломается. Вспомните, как часто у вас ломался грифель?
Тем не менее, оба минерала являются родственными друг другу. Более того, воссоздание специальных условий позволяет осуществить процесс превращения из графита в алмаз, так и наоборот.
Прочтение статьи позволит вам узнать какими свойствами обладают представленные в статье минералы, о том, как они вообще появились на Земле, куда нужно отправиться для того, чтобы добывать алмазы. Или, если повезет меньше, графит, а также, возможно ли изготовление алмазов и графита в домашних условиях.
Желаем приятного прочтения!
Понятие аллотропии
Понятия «Аллотропия» имеет древнегреческие корни: αλλος — другой, τροπος — свойство. Аллотропия — существование двух и более простых веществ одного и того же химического элемента. Понятие аллотропии введено в науку Й. Берцелиусом в 1841 году для обозначения разных форм существования элементов.
Явление аллотропии подразумевает возможность создания из одного и того же элемента определенного количества различных веществ. Например, кислород и озон в своем составе содержат только лишь оксиген. Вопрос о том, как это вообще возможно, на протяжении длительного периода времени интересовал многих людей. На сегодняшний момент ученые легко могут объяснить все особенности этого процесса.
Далеко не все элементы способны образовывать несколько разных простых веществ. Такая способность напрямую зависит от структуры молекул. Чаще всего подобное явление наблюдается у элементов, которые имеют переменные окислительные степени.
Это касается таких групп, как:
- неметаллы;
- полуметаллы;
- благородные газы;
- галогены.
Причины аллотропии могут быть нескольких типов. К наиболее вероятным из них ученые относят такие факторы, как:
- Различное количество атомов, необходимых для образования одной молекулы.
- Отличающийся порядок сопряжения атомов в одну молекулу.
- Параллели между спинами электронов.
- Разновидность кристаллической решетки.
Для того чтобы наглядно понять, каким образом может существовать явление аллотропии, необходимо рассмотреть несколько наиболее примечательных примеров, широко встречающихся в природе.
Примеры аллотропии:
При нагревании металлов в процессе превращения поглощается тепло, при этом изменение решеточной конструкции происходит при одной и той же температуре. Аллотропным модификациям подвергаются многие металлы, например, титан, железо, олово и др. Железо при нагревании до +1390 ºС характеризуется гранецентрированной решеткой. Повышение температуры до +1540 ºС ведет к перестройке до центрировано-кубической структуры.
Понятие и основные характеристики минералов
Алмазом называют прозрачный кристалл, не имеющий цвета, обладающий высокими характеристиками преломления света. Выделяют следующие основные свойства минерала:
Природа зарождает как алмазы определенных форм, так и в нескольких кристаллических формах, что обусловлено его внутренним строением. Ярко выраженные кристаллы имеют форму куба или тэтраэдра с плоскими гранями. Иногда грани кажутся рельефными из-за наличия невидимых глазу многочисленных наростов и преобразований.
Хотя многие считают алмаз самым прочным материалом на свете, но науке известно вещество превосходящее алмаз по прочности более чем на 11% — «гипералмаз».
Графит представляет собой кристаллическое вещество серо-черного цвета, обладающее металлическим блеском. По составу графит имеет слоистую структуру, его кристаллы состоят из мелких тонких пластинок. Это очень хрупкий минерал, напоминающий по внешнему виду сталь или чугун. У графита низкая теплоемкость, но высокая температура плавления. Кроме того, этот минерал:
На ощупь графит жирный, а при проведении по бумаге оставляет следы. Это происходит из-за того, что атомы кристаллической решетки слабо связаны.
Аллотропные модификации углерода
Аллотропные модификации углерода по своим свойствам наиболее радикально отличаются друг от друга, от мягкого к твёрдом и т.п.
История открытия:
Углерод в виде угля, копоти и сажи известен человеку с незапамятных времен; около 100 тыс. лет назад, когда наши предки овладели огнём. Вероятно, очень рано люди познакомились и с аллотропными изменениями углерода – алмазом и графитом, а также с ископаемым углем. Не удивительно, что горение углеродсодержащих веществ было одними из первых химических процессов, заинтересовавших человека.
Элементом был огонь-явление, сопровождающее горение; в учениях об элементах древности огонь обычно фигурирует в качестве одного из элементов. На рубеже XVII-XVIII вв. возникла теория флогистона, выдвинутая Бехером и Шталем. Эта теория признавала наличие в каждом горючем теле особого элементарного вещества – невесомого флюида-флогистона, улетучивающегося в процессе горения.
Так как при сгорании большого количества угля остается лишь немного золы, флогистики полагали, что уголь-это почти чистый флогистон. Именно этим объясняли, в частности, «флогистирующее» действие угля, — его способность восстанавливать металлы из «известей» и руд. Позднейшие флогистики, Реомюр, Бергман и др., уже начали понимать, что уголь представляет собой элементарное вещество. Однако впервые таковым «чистый уголь» был признан Лавуазье, исследовавшим процесс сжигания в воздухе и кислороде угля и других веществ.
В книге Гитона де Морво, Лавуазье и Фуркруа «Метод химической номенклатуры» (1787) появилось название «углерода» вместо французского «чистый уголь». Под этим же названием углерод фигурирует в «Таблице простых тел» в «Элементарном учебнике химии» Лавуазье. В 1791 году английский химик Теннант первым получил свободный углерод; он пропускал пары фосфора над прокаленным мелом, в результате чего образовывался фосфат кальция и углерод. То, что алмаз при сильном нагревании сгорает без остатка, было известно давно.
Еще в 1751 году французский король Франц I согласился дать алмаз и рубин для опытов по сжиганию. Оказалось, что сгорает лишь алмаз, а рубин (окись алюминия с примесью хрома) выдерживает без повреждения длительное нагревание в фокусе зажигательной линзы. Лавуазье поставил новый опыт по сжиганию алмаза с помощью большой зажигательной машины, пришел к выводу, что алмаз представляет собой кристаллический углерод.
Второй аллотроп углерода – графит в алхимическом периоде считался видоизмененным свинцовым блеском и назывался plumbago; только в 1740 году Потт обнаружил отсутствие в графите какой – либо примеси свинца. Шееле исследовал графит (1779) и будучи флогистиком счел его сернистым телом особого рода, особым минеральным углем, содержащим связанную «воздушную кислоту» (СО2) и большое количество флогистона. Двадцать лет спустя Гитон де Морво путем осторожного нагревания превратил алмаз в графит, а затем в угольную кислоту.
Международное название Carboneum происходит от латинского carbo (уголь). Слово это очень древнего происхождения. Его сопоставляют с cremare – гореть; корень car, cal, русское гар, гал и гол, санскритское cra означает кипятить, варить. Со словом «carbo» связаны названия углерода и на других европейских языках (carbon, charbone и др.). Немецкое Kohlenstoff происходит от Kohle – уголь.
Древнерусское угорати, или угарати (обжигать, опалять) имеет корень гар, или гор, с возможным переходом в гол; уголь по-древнерусски югъль, или угъль, того же происхождения. Слово алмаз происходит от древнегреческого – несокрушимый, непреклонный, твердый, а графит от греческого – пишу. В начале XIX в. Старое слово уголь в русской химической литературе иногда заменялось словом «углетвор» (шере, 1807; Севергин, 1815); с 1824 г. Соловьев ввел название углерод.
Сравнение
Явление, при котором вещества имеют различные свойства, но образованы общим химическим элементом, называется аллотропией. Однако в природе, пожалуй, больше не найдется таких абсолютно разных аллотропных форм одного и того же элемента. Чем объясняется отличие алмаза от графита?
Решающую роль здесь играют особенности кристаллической структуры каждого из веществ. Скажем про алмаз. Связь между его атомами невероятно прочная. Это обусловлено способом их расположения относительно друг друга. Смежные атомные ячейки вещества имеют кубическую форму. Частицы расположены в углах ячеек, на их гранях и внутри них. Этот тип строения называется тетраэдрическим.
Ячейка алмаза
Такая геометрия атомов обеспечивает наиболее плотную их организацию, благодаря чему алмаз становится твердым, не поддающимся деформации. Вместе с тем это хрупкое вещество, способное раскалываться от удара. Строением также обуславливается высокая теплопроводность алмаза и свойство его кристаллов преломлять свет.
Графит обладает иной структурой. На атомном уровне он состоит из пластов, расположенных в разных плоскостях. Каждый пласт составляют примыкающие друг к другу шестиугольники, подобно сотам. Связь между атомами, которые являются вершинами шестиугольников, сильна только в пределах каждого слоя. А атомы, находящиеся в разных слоях, практически независимы друг от друга.
Структура графита
След от карандаша – это легко отделяемые слои графита. Вещество из-за особенностей строения поглощает свет, принимая достаточно невзрачный вид (но с металлическим блеском), и обладает электропроводностью.
Присущие минералам свойства определяют их пригодность в той или иной сфере. В чем разница между алмазом и графитом относительно их применения? Блистающий алмаз идеален для ювелирного производства. А твердость этого материала позволяет изготавливать из него качественные резцы по стеклу, суперпрочные сверла и другие востребованные изделия.
Графитовые стержни при протекании многих процессов играют роль электродов. Измельченный графит входит в состав минеральных красок и применяется как смазочный материал. А из смеси этого вещества и глины производят специальные емкости для плавки металлов.
Это интересно: Что такое камни для виски и зачем они нужны: тонкости применения и выбора
Алмаз
Углерод имеет множество аллотропных модификаций. Основные из них – графит, алмаз, карбин. Они отличаются друг от друга физическими, химическими свойствами, строением кристаллической решётки. Наиболее твёрдая модификация – алмаз – используется для изготовления промышленных инструментов.
Согласно современным теоретическим представлениям, тверже алмаза ничего в мире быть не может — такова у него кристаллическая решетка. Можно сказать, что алмаз — самый крепкий минерал в мире. Плавится алмаз при высоких температурах, от 3700 до 4 тыс. градусов. Но еще раньше, при 850 градусах, он начинает гореть, а без доступа воздуха при достижении половины от температуры плавления превращается в графит.
История добычи
Алмазы не всегда были драгоценными камнями, имевшими ценность и шкалу стоимости. В природе этот камушек непривлекателен — простая шершавая стекляшка. Ценность ему придает огранка. Все изменилось в XIX веке, когда в Южной Африке около современного города Кимберли на ферме братьев де Бирс обосновались искатели алмазов. Камней на этих землях было много. Настоящая промышленная их добыча стала связана с именем Сесиля Родса.
Сесиль Родс стал монополистом на рынке алмазов, чему поспособствовали Ротшильды, а бриллианты стали потребительским товаром, доступным не только королям. Монопольное положение де Бирс пошатнулось только в середине XX века благодаря антимонопольному законодательству в США и началу массовой добычи в странах, где возможностей захвата рынка в принципе не было — например, в СССР. Существует несколько способов огранки алмазов, при которой они лучше всего проявляют такое свое свойство, как игру цвета. Играет свою роль и исходная форма камня, поскольку огранщик старается свести его потери к минимуму.
Наиболее распространенными формами бриллианта являются:
- круглая, 57 граней;
- овальная;
- «груша»;
- «маркиза»;
- радиант;
- квадрат;
- «принцесса».
Структура алмаза:
Один атом углерода окружен еще четырьмя атомами в виде четырехгранного треугольника или пирамиды. Каждый атом находится на одинаковом расстоянии друг от друга. Связь у атомов очень крепкая, именно поэтому алмаз является таким твердым и прочным. Еще одно свойство алмаза — это то, что он может проводить свет, в отличие от графита.
Как отличить алмаз от подделки
Чаще всего для создания искусственных образцов используется стекло. Графит требует больше вложений и времени, а также внешне никак не отличается от настоящего образца. Натуральный камень должен удовлетворять следующим критериям:
- Дефекты. Даже самый чистый бриллиант с идеальной огранкой должен иметь минимальные изъяны (мелкие трещины, шероховатость). Искусственный аналог чаще всего обладает идеальной формой без каких-либо изъянов.
- Прозрачность. Хотя алмаз отличается высокой чистотой, через него нельзя увидеть четких очертаний предметов. В противном случае изделие является подделкой из стекла.
- Блеск. Наличие огранки усиливает изначальную степень преломления света. Настоящий минерал должен сверкать, причем весьма ярко.
- Запотевание. Если образец подобным образом реагирует на повышенную влажность, то он является искусственным.
- Прочность. Натуральный материал крайне сложно повредить, поэтому можно смело попробовать оцарапать его поверхность. Если на ней остаются следы, это говорит о подделке.
- Влияние тепла. Украшение не должно быстро нагреваться. Если через короткий промежуток времени после контакта с человеческим телом оно стало теплым, значит бриллианты не являются настоящими.
ИСКУССТВЕННЫЙ АЛМАЗ
На такое дорогостоящее изделие часто выдается специальный сертификат, который служит доказательством его происхождения. Также бриллиант не должен блестеть различными цветами радуги – это признак низкого качества (наличие примесей) или подделки. Блеск должен быть исключительно одного оттенка (зависит от цвета камня, чаще всего серый).
Графит
Графи́т — минерал из класса самородных элементов, одна из аллотропных модификаций углерода. Структура слоистая. Слои кристаллической решётки могут по-разному располагаться относительно друг друга, образуя целый ряд политипов, с симметрией от гексагональной сингонии (дигексагонально-дипирамидальный), до тригональной (дитригонально-скаленоэдрический).
Слои слабоволнистые, почти плоские, состоят из шестиугольных слоёв атомов углерода.
История добычи:
В 60-х годах XVI столетия в Англии. Местные пастухи, нашедшие залежи странного черно-блестящего материала, приняли его сначала за свинец, но, поняв, что пуль из него не отольешь, стали отбивать куски черного камня и метить им своих овец. На новый материал скоро обратили внимание художники и коммерсанты, быстро наладившие на английских улицах торговлю тонкими пластинками и кусочками графита. Конечно, пользоваться им было очень неудобно — руки пачкались! Приходилось обматывать графит веревкой, бумагой, а то и просто зажимать между дощечек. Так появились первые карандаши в деревянном корпусе.
Структура графита:
Физические свойства в графите сильно различаются по направлениям – перпендикулярному и параллельному слоям атомов углерода.
При нагревании без доступа воздуха графит не претерпевает никаких изменений до 3700°С. При указанной температуре он возгоняется, не плавясь.
Искусственный графит получают из лучших сортов каменного угля при 3000°С в электрических печах без доступа воздуха.
Графит термодинамически устойчив в широком интервале температур и давлений, поэтому он принимается в качестве стандартного состояния углерода. Плотность графита составляет 2,265 г/см3.
Известны две формы графита: альфа-графит (имеет гексагональную структуру и кристаллическую решетку) и бета-графит (имеет ромбоэдрическую структуру и кристаллическую решетку). У α-графита половина атомов каждого слоя располагается над и под центрами шестиугольника, а у β-графита каждый четвёртый слой повторяет первый.
Альфа-графит может быть преобразован в бета-форму с помощью механической обработки. Бета-форма переходит в альфа-форму при нагревании графита свыше 1300 °C.
Определение
Алмаз – минерал, основой которого является углерод. Характеризуется метастабильностью, то есть способностью в обычных условиях неограниченно долго существовать в неизменном виде. Помещение алмаза в специфические условия, например в вакуум при повышенной температуре, приводит к его переходу в графит.
Алмаз
Графит – минерал, выступающий модификацией углерода. При трении от общей массы вещества отделяются чешуйки. Наиболее известное применение графита – изготовление из него карандашного грифеля.
Графит
Фуллерен
Фуллерен, бакибол, или букибол — молекулярное соединение, принадлежащее к классу аллотропных форм углерода и представляющее собой выпуклые замкнутые многогранники, составленные из чётного числа трёх координированных атомов углерода. Уникальная структура фуллеренов обуславливает их уникальные физические и химические свойства. В соединении с другими веществами они позволяют получить материалы с принципиально новыми свойствами.
История добычи:
Открытие фуллерена произошло в результате экспериментов Смолли и Крото с инструментом, который Смолли изобрел для изучения молекул и атомных кластеров. Крото заинтересовала предложенная Смолли методика лазерного испарения. С ее помощью он намеревался проверить свою теорию о поведении углерода в межзвездном пространстве. Крото считал, что богатые углеродом красные гиганты способны испускать сложные углеродные соединения, которые можно обнаруживать с помощью радиотелескопов.
Структура фуллерена:
Атом связь Фуллерен является новой аллотропной формой углерода. Молекулы фуллерена состоят из 60,70 атомов, образующих сферу. Кристаллические фуллерены представляют собой полупроводники. Разнообразие физико-химических и структурных свойств соединений на основе фуллеренов позволяет говорить о химии фуллеренов как о новом перспективном направлении органической химии.
Атомы углерода расположены в вершинах правильных шести- и пятиугольников, из которых составлена поверхность сферы или эллипсоида. Самый симметричный и наиболее полно изученный представитель семейства фуллеренов фуллерен (C60), в котором углеродные атомы образуют усечённый икосаэдр, состоящий из 20 шестиугольников и 12 пятиугольников и напоминающий футбольный мяч.
Следующим по распространённости является фуллерен C70, отличающийся от фуллерена C60 вставкой пояса из 10 атомов углерода в экваториальную область C60, в результате чего молекула C70 оказывается вытянутой и напоминает своей формой мяч для игры в регби. Так называемые высшие фуллерены, содержащие большее число атомов углерода (до 400), образуются в значительно меньших количествах и часто имеют довольно сложный изомерный состав. Среди наиболее изученных высших фуллеренов можно выделить Cn, n=74, 76, 78, 80, 82 и 84.
Физические свойства
Физические свойства. Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Поэтому разные модификации проявляют очень разные физические свойства это и очень твердое вещество, и мягкое вещество проводящее электрический ток и многие другие.
Алмаз:
Физ. свойства. Алмаз и графит резко отличаются по физ. Свойствам. Алмаз – прозрачные кристаллы, очень твердые. Твердость объясняется строением его кристаллической решетки. Графит – мягкое темно-серое вещ-во с Ме блеском.
Графит:
Физические свойства графита. – мягкое черное вещество из легко слоящихся кристалликов, — проводит электрический ток, — графит высокой чистоты применяют в ядерных реакторах в качестве замедлителя нейтронов. — температура плавления при повышенном давлении равна 3527° C. — При обычном давлении графит сублимирует при 3780° C.
Фуллерен:
Физические свойства фуллерена Конденсированные системы, состоящие из молекул фуллеренов, называются фуллеритами. Наиболее изученная система такого рода — кристалл С60, менее — система кристаллического С70. Исследования кристаллов высших фуллеренов затруднены сложностью их получения.
Сходство и взаимопревращения алмаза и графита
У мягкого серого графита и твердого прозрачного алмаза общая основа – углерод, т. е. они состоят из одного вещества. Это натолкнуло ученых на мысль о попытке преобразовать графит в алмаз.
Получить алмаз из графита можно в лаборатории или домашних условиях. В первом случае нужны следующие условия:
- газовая среда (метан);
- давление более 50 тысяч атмосфер;
- температура выше 1200 °С;
- наличие катализаторов (платины, никеля, железа).
Для домашних экспериментаторов есть 2 способа. В первом понадобится:
- источник тока;
- графит;
- холодная вода или жидкий азот;
- провод.
Провод привязывается к графиту, опускается в емкость. После охлаждения в морозильной камере или с помощью жидкого азота через полученную конструкцию с проводом пропускается ток. Это способствует перестройке кристаллической решетки, быстрому преобразованию в самоцвет.
Второй способ предполагает появление алмаза из смеси соли, графита и дистиллированной воды. Нить опускается в банку с подготовленным раствором, на ней постепенно нарастает кристалл.
Получить графит из кристалла можно путем его нагревания от 1000 °С, при температуре от 1750 °С процесс происходит быстро.
Также смотрите обратный способ получения графита из искусственных алмазов:
Химические свойства
Алмаз:
При обычной температуре углерод малоактивен. Он может быть, как восстановителем, так и окислителем. Как восстановитель: Горит на воздухе.
Графит:
Химические свойства. Со многими веществами (щелочными металлами, солями) образует соединения включения. Реагирует при высокой температуре с воздухом, сгорая до углекислого газа.
Фуллерен:
Восстановление, нуклеофильное присоединение, цикло присоединение, региохимическое множественное присоединение, галогенирование, модифицирование фуллеренов, кластерами гидрирование, присоединение радикалов, образование комплексов, переходных металлов окисление и реакции с электрофильными реагентами.
Практическая часть
Применение аллотропных модификаций углерода. Алмаз – в промышленности: его используют для изготовления ножей, свёрл, резцов; в ювелирном деле. Перспектива – развитие микроэлектроники на алмазных подложках. Графит – для изготовления плавильных тиглей, электродов; наполнитель пластмасс; замедлитель нейтронов в ядерных реакторах; компонент состава для изготовления стержней для чёрных графитовых карандашей (в смеси с каолином) Фуллерен – в аккумуляторах и электрических батареях (добавки фуллерена); фармакология (лечение ВИЧ); солнечные элементы; огнезащитные краски.
Новая аллотропная модификация:
15 августа 2021 года группа учёных из IBM и Оксфордского университета опубликовала статью, в которой представлены данные об успешном синтезе молекулы цикло [18] углерода. Ранее существование циклоуглеродов считалось лишь гипотетическим, но теперь C18 — представитель новой аллотропной модификации углерода.
C18 был получен путём удаления монооксида углерода из молекулы C24O6 принципом атомно-силовой микроскопии на двухслойной поверхности хлорида натрия при температуре 5°K (-268,15°С). По мнению учёных, циклоуглероды могут оказаться полезными в компьютерных технологиях в качестве чрезвычайно энергоэффективного компьютерного логического устройства. Кроме того, создание С18 открывает путь для синтеза других углеродных аллотропов, но пока что предстоит глубокое изучение свойств новой молекулы.
Заключение
Углерод — вещество с самым большим числом аллотропических модификаций. В проекте рассмотрены аллотропные модификации алмаза, графита, фуллерена. Углерод и его аллотропные модификации имеют большое практическое значение в жизни человека и промышленности.
Большинство вещей в нашей жизни мы получили благодаря аллотропным модификациям, например, сверло, чёрные графитовые карандаши и батарейки.
Благодаря этому проекту мы узнала, как и кто помог нам в улучшении нашей жизни.
Исходя из всей проделанной работы, мы можем сделать следующие выводы:
- Во-первых, я подробно изучила и рассмотрела виды аллотропии.
- Во-вторых, я узнала кто открыл аллотропии, и где она применяется.
- В-третьих, я сделала стенд где наглядно показано как выглядит аллотропия.
Сфера применения
Алмаз и графит используют гораздо шире, чем может показаться на первый взгляд. Алмазы нашли свое применение в следующих сферах:
В процентном соотношении использования алмазов выглядит так:
- Инструменты, машинные детали – 60%.
- Обрамление шлифовочных кругов -10%.
- Переработка проволоки-10%.
- Бурение скважин – 10%.
- Ювелирные изделия, мелкие детали – 10%.
Что касается графита, то в чистом виде он практически не используется, а подвергаются предварительной обработке, хотя в разных сферах используется графит разного качества. Для канцелярских карандашей используют графит высочайшего качества. Наиболее широкое применение нашло в литейном производстве, обеспечивая гладкую поверхность различных форм стали. Здесь используется практически необработанный графит.
Электроугольная промышленность наряду с природным использует искусственно созданный графит, также получивший широкое применение благодаря особой чистоте и постоянству состава. Электропроводимость сделала графит материалом для электродов электрических приборов. В металлургии используется как смазочный материал.
Алмаз и графит – одинаковые по составу, но по-своему уникальные вещества. Польза графита для различных отраслей промышленности гораздо выше алмаза.
Алмаз же, призванный радовать своей красотой, неоценим для экономики, принося огромные доходы от применения в ювелирной промышленности.
Твердый, играющий на свету алмаз и непрозрачный, легко отслаивающийся графит образно можно назвать родными братьями. Ведь в химическом составе того и другого присутствует единственный элемент – углерод. Выясним, почему, имея общее происхождение, эти минералы настолько не похожи друг на друга и чем отличается алмаз от графита.